Новости
20 мая 2021 Новости
Бизнес-процессы крупной фармкомпании или контрактной исследовательской организации разрабатывают и поддерживают разные функциональные подразделения, такой подход имеет исторические предпосылки и рациональное обоснование. Соответственно, в ходе автоматизации бизнес-требования анализируются изолированно друг от друга и реализуются при помощи специализированного программного обеспечения.
Системные интеграции выполняют следующие задачи:
При этом преследуются цели, поставленные перед Спонсором Правилами Надлежащей Клинической Практики - обеспечить целостность данных и полноту контроля за ходом исследования.
В любой GxP-регулируемой области первостепенное значение имеет валидация интегрируемых систем и безопасной передачи информации.
Риски существенно снижаются, если интегрируемые системы разработаны на общей платформе и с применением схожих технологий, то есть каждая система в отдельности и обе они вместе являются системой компьютеризированной.
В этом отношении системы MainEDC™ и Flex Pharmacovigilance идеально совместимы. Оба продукта принадлежат единой группе компаний и практикуют симметричные методы разработки, внедрения и поддержки.
Итак, в чем смысл интеграции этих двух систем?
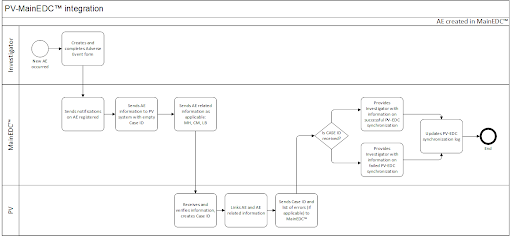
Исследователь идентифицировал нежелательное явление в ходе клинического исследования и заполнил соответствующую форму эИРК
→
данные автоматически передаются, попутно забирая связанные данные с других заполненных для данного субъекта форм эИРК, в систему фармаконадзора и формируют Case
→
Сотрудник службы фармаконадзора получает уведомление и выполняет необходимые действия, включая репортирование SAE и SUSAR - для этого в принимающей системе предусмотрено автозаполнение форм и формирование отчетов
→
Исследователь получает подтверждение об обработке Case
→
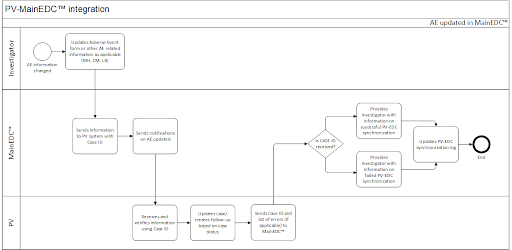
Похожий процесс предусмотрен для последующего обновления информации в эИРК - данные без задержки поступают в службу фармаконадзора.
Процесс гибко настраивается в соответствии с требованиями конкретного заказчика и не обязательно является односторонней интеграцией. Например, медицинское кодирование можно направить в обратную сторону - тогда назначенные сотрудником фармаконадзора коды нежелательного явления отобразятся в системе EDC.
Другие новости