Специалисты в клинических исследованиях знают, что абсолютное большинство топ-фармацевтических компаний и КИО предпочитают централизовано контролировать инфраструктуру управления данными. Мы попробовали собрать воедино аргументы "за" и плюсы подобного подхода для российских Спонсоров и КИО.
Эффекты подобного решения:
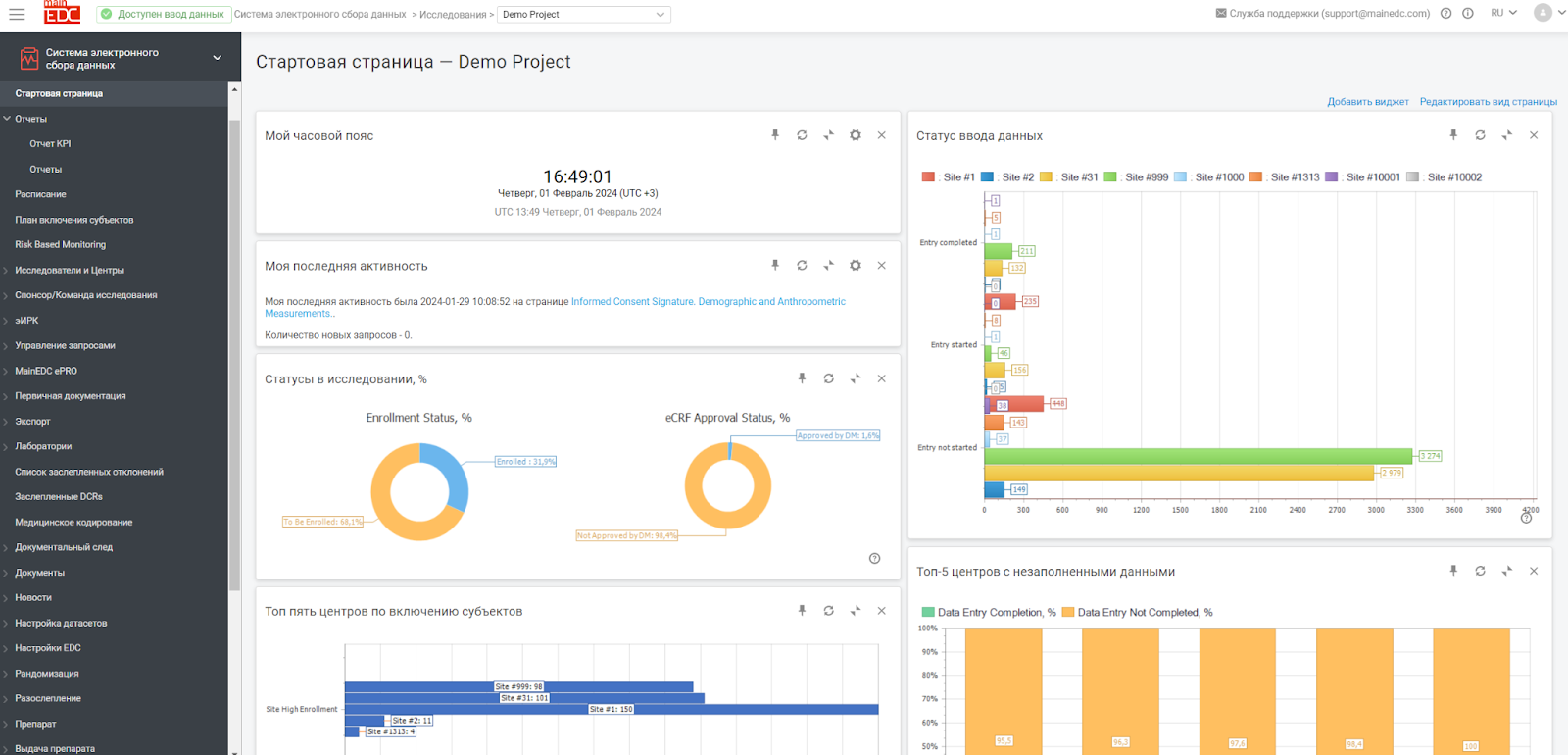
Стандартизация данных, формирование единого подхода к сбору и обработке данных (система качества), включая риск-ориентированный мониторинг (RBM): Единая платформа обеспечивает стандартизацию процессов Clinical Data Management / Clinical Data Science, форматов данных и методов сбора данных. Это существенно упрощает агрегацию и анализ данных из разных исследований, все данные собираются и обрабатываются одинаково, в полном соответствии с российскими и международными стандартами, что позволяет быть уверенным в соблюдении регуляторных норм и совместимости.
 Стандартизация процессов:
Стандартизация процессов: Единая система обеспечивает сопоставимость в методах сбора, обработки и анализа данных, что повышает их надежность.
Эффективное управление рисками: Риск-ориентированный мониторинг (RBM) становится более эффективным, так как единая система позволяет лучше идентифицировать, оценивать и нивелировать риски на всех этапах клинического исследования, создавая преемственность на всем жизненном цикле лекарственного средства - доклинике, между фазами и в стадиях пост-маркетинга.
Улучшенный анализ и прогнозирование: Стандартизированный сбор данных позволяет использовать более сложные аналитические и статистические методы для прогнозирования результатов и выявления тенденций.
Снижение операционных рисков: Единая система сбора данных снижает вероятность ошибок и несоответствий, возникающих при использовании разрозненных систем и инструментов.
Улучшенное решение проблем и быстрое вмешательство: Централизованный мониторинг и анализ данных позволяют быстрее выявлять проблемы и незамедлительно принимать меры для их устранения.
Обеспечение соответствия нормативным требованиям: Единая система упрощает процесс обеспечения соответствия требованиям регуляторов, так как все данные собираются и обрабатываются в соответствии с одними и теми же стандартами и практиками.
Создание единого архива больших медицинских изображений Спонсора: Позволяет в едином формате накапливать, анализировать и архивировать для будущих исследований, в том числе с применением ИИ, всех медицинских изображений (DICOM) и других файлов с данными медицинских исследований.
 Экономия затрат:
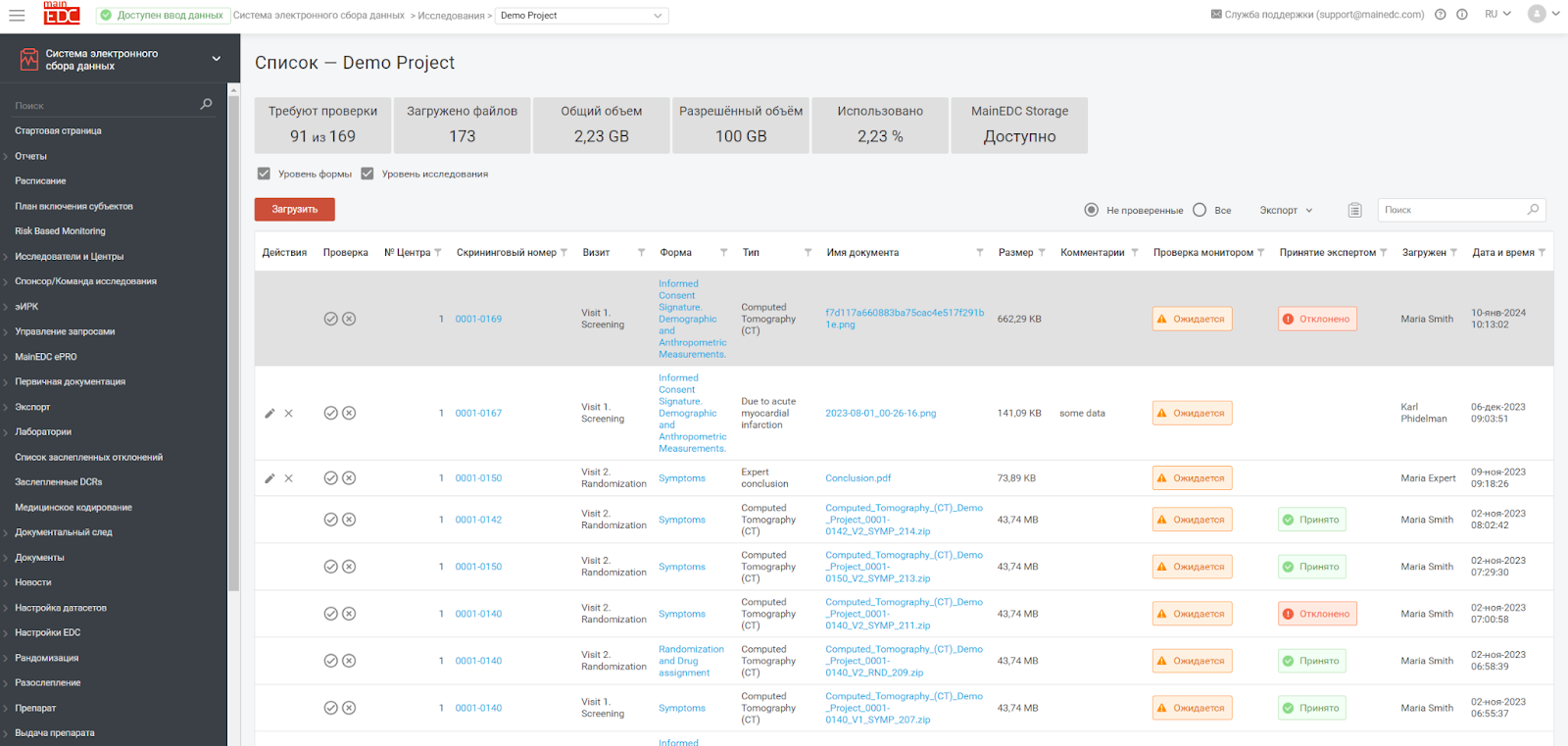
Экономия затрат: При долгосрочном сотрудничестве снижаются затраты на интеграцию и поддержку множества различных систем. Драматически снижается стоимость первичной валидации инсталляции платформы, по сути она требуется только один раз, а не в каждом выделенном проекте. Помимо этого, мы предоставляем значительные скидки в зависимости от количества исследований, проводимых на платформе. Затраты становятся прогнозируемыми и не содержат транзакционных и налоговых издержек. Например, эффективная цена проведения одного проекта биоэквивалентности составляет менее 50 тыс. руб на весь срок исследования.
Интеграция систем: Единая платформа надежнее, она однократно интегрируется с другими корпоративными системами и инструментами управления данными, что обеспечивает более эффективный обмен данными и управление ими, позволяя стандартизировать и упростить работу с данными для биостатистиков и команды Спонсора.
 Обучение и поддержка:
Обучение и поддержка: Сотрудникам и исследователям достаточно однократного обучения работе с системой, что экономит время и ресурсы. Кроме того, мы, как единый поставщик, предоставляем согласованную и эффективную поддержку на русском и английском языках, включая экстренную поддержку 24/7.
 Снижение рисков и повышение безопасности:
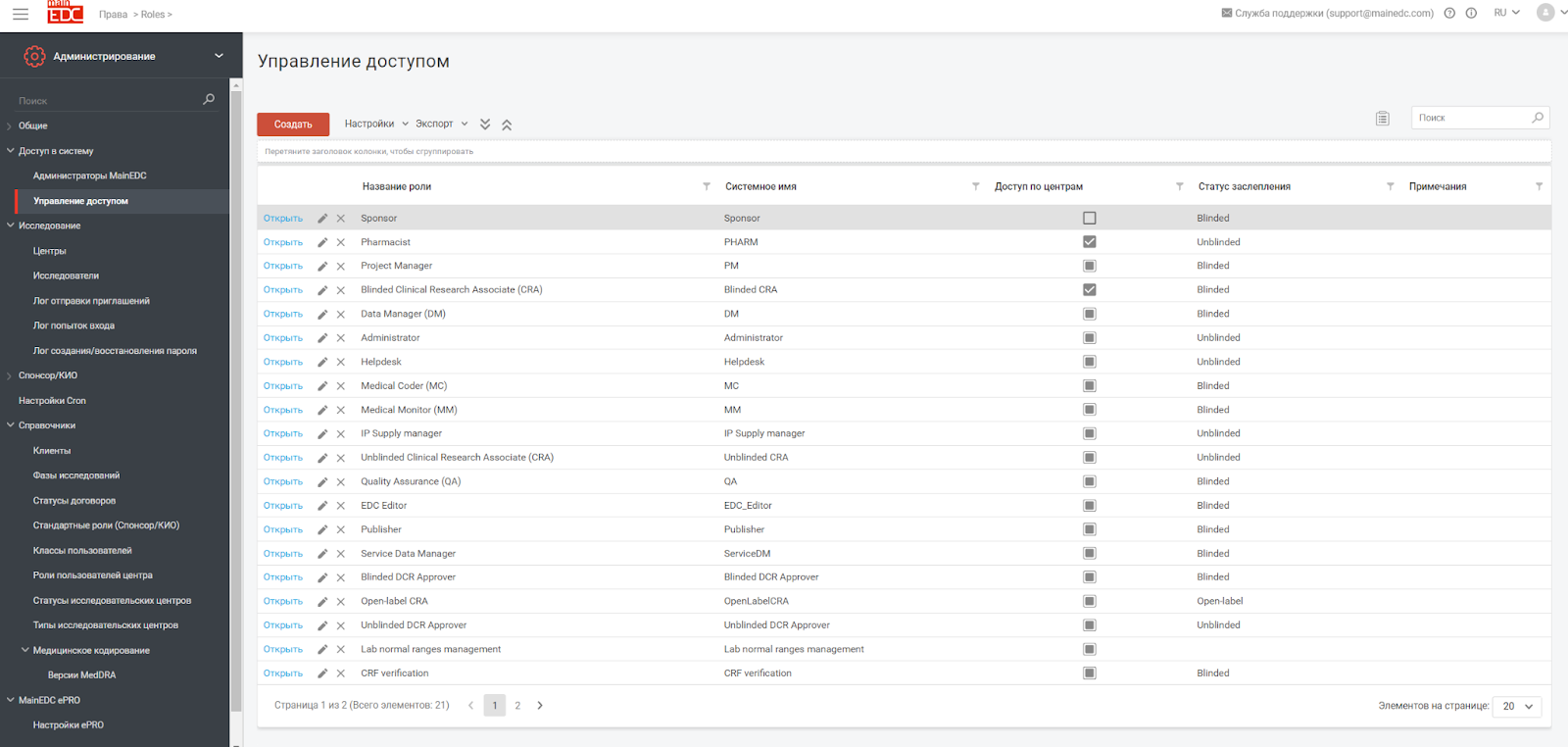
Снижение рисков и повышение безопасности: Использование множества систем от разных вендоров и даже одной системы, но через разных вендоров, увеличивает риск нарушений безопасности и ошибок в данных. Единая система облегчает контроль за безопасностью и целостностью данных, который полностью контролируется. Доступность данных при таком подходе максимальная.
Быстрота реализации проектов: Стандартизированный набор инструментов позволяет быстрее настраивать новые исследования, так как большая часть процессов и инфраструктуры уже налажена. Появляется возможность даже при вовлечении разных третьих сторон, передавать им в едином стандарте опыт и наработки из других проектов (например, в проектах ранних фаз, БЭ, маркетинговых проектов с доступом пациента, экономия на Clinical Data Management / Data Science начиная со второго проекта может составлять до 90% бюджета).
Улучшение совместимости и обмена данными: Единое ПО обеспечивает более легкий обмен данными между разными проектами и отделами, а также облегчает совместную работу с внешними партнерами.
 Управление изменениями и обновлениями:
Управление изменениями и обновлениями: При работе с единым поставщиком легче управлять обновлениями ПО и вносить изменения в систему, так как это затрагивает только одну платформу.
Безопасность пациентов: Использование единого поставщика ПО позволяет унифицировать процессы фармаконадзора во всех клинических исследованиях. Это означает, что мониторинг безопасности лекарственных средств и сбор информации о побочных эффектах будет проводиться по единым стандартам с возможностью непрерывного потока данных от пациента до Спонсора и, при необходимости, регулятора. Такая стандартизация важна для обеспечения точности и надежности данных о безопасности препаратов. Кроме того, метод облегчает сравнение данных по безопасности между различными исследованиями, повышает качество мониторинга и ускоряет процесс выявления потенциальных проблем с безопасностью препаратов. Единый подход к фармаконадзору также способствует более эффективному обучению персонала, улучшает отчетность и повышает общую эффективность процесса наблюдения за безопасностью лекарственных средств.
Возможность оперативного мониторинга всех проектов в единой системе: Использование единого поставщика ПО для сбора данных в клинических исследованиях позволяет централизовать мониторинг всех проектов, обеспечивая оперативный доступ к информации о ходе каждого исследования. Это дает преимущества в централизованном управлении, позволяет быстро и единообразно анализировать данные и получать отчетность, дает высокую прозрачность и возможности контроля, видение общей картины всех исследований как на карте помогает лучше распределять ресурсы и приоритеты между проектами. Помимо этого, централизованная система упрощает обмен информацией между участниками разных проектов, что способствует более эффективной коммуникации и сотрудничеству.
Создание собственного банка данных: Выбор единой платформы для клинических исследований также способствует созданию и управлению собственным банком данных. Это имеет ряд важных преимуществ:
- Централизованное хранение данных: Все данные из различных исследований хранятся в одной системе, что упрощает управление данными и их анализ.
- Долгосрочное хранение и доступность: Создание собственного банка данных позволяет сохранять исторические данные исследований на длительный срок, обеспечивая их доступность для будущих анализов и сравнений.
- Улучшение качества и целостности данных: Централизованное хранение данных с едиными стандартами качества и безопасности повышает их надежность и целостность.
- Облегчение регуляторной отчетности и соответствия нормам: Единый банк данных упрощает процесс подготовки отчетов для регуляторных органов и обеспечивает соответствие всей информации установленным нормам и стандартам.
- Поддержка мета-анализов и исследовательских инициатив: Наличие централизованного банка данных позволяет проводить мета-анализы и другие исследования, объединяющие данные из разных проектов, что может способствовать новым научным открытиям.
- Лучшая защита и управление данными пациентов: Централизованный подход к хранению данных повышает уровень защиты личной информации пациентов и обеспечивает более эффективное управление этой информацией.
Нами накоплен колоссальный опыт внедрения
экосистемы MainEDC™ в качестве
единого решения для проведения всех клинических исследований любых фаз, доклинических, регистрационных, RWE и постмаркетинговых исследований. Мы возьмем на себя все процессы, от аналитической проработки и оценки текущего состояния процессов сбора, обработки и представления данных у вас в компании (Clinical Data Management/ Data Science) до создания системы качества, внедрения эко-системы и обучения пользователей.
Напишите нам сегодня!